doi: 10.56294/dm202276
REVISIÓN SISTEMÁTICA
Cholestasis gravidarum in women in the second and third trimester of gestation, clinical and specific pharmacological treatment and its benefits. An evidence-based approach
Colestasis gravídica en mujeres del segundo y tercer trimestre de gestación, clínica y tratamiento farmacológico especifico y sus beneficios. Un enfoque basado en la evidencia
Lorran Nobre Da Silva1 ![]() *, Marcelo Adrian Estrin1
*, Marcelo Adrian Estrin1
![]() *
*
1Facultad de Medicina y Ciencias de la Salud, Universidad Abierta Interamericana. Ciudad Autónoma de Buenos Aires, Argentina.
Citar como: Nobre Da Silva L, Estrin MA. Cholestasis gravidarum in women in the second and third trimester of gestation, clinical and specific pharmacological treatment and its benefits. An evidence-based approach. Data and Metadata. 2022;1:38. https://doi.org/10.56294/dm202276
Enviadoo: 25-09-2022 Revisado: 31-10-2022 Aceptado: 02-12-2022 Publicado: 03-12-2022
Editor: Prof.
Dr. Javier González Argote ![]()
ABSTRACT
Introduction: cholestasis gravidarum is a syndrome that usually occurs in pregnant women in the second or third trimester of gestation and ends in the puerperium. It is clinically characterized by the presence of predominantly nocturnal pruritus that is initially palmo-plantar and then generalized. With alterations in liver function with or without jaundice and elevated serum bile acid levels, biochemical cholestasis is classified as mild to moderate severity.
Objective: diagnostic methods and pharmacological treatment approaches that provide the best results for these patients.
Methods: systematic review using the terms MESH (cholestasis of pregnancy) that generated 2597 results.
Results: 28 papers were analyzed in more detail, of which 12 papers were finally selected for the final analysis. Treatment: Ursodeoxycholic acid (UDCA), a beta epimer of chenodeoxycholic acid, is a bile acid more polar than primary bile acids, with substantial choleretic and other multiple chemoprotective effects. The mechanism of action is not completely understood, but studies have shown that after treatment there is a reduction in total serum bile acids in both maternal and cord serum and a qualitative change in the serum bile acid pool. When compared with all controls, UDCA was also found to be associated with a decrease in the incidence of preterm birth, neonatal respiratory distress, and the number of neonatal admissions to intensive care units.
Conclusions: the treatment of cholestasis gravidarum is oral administration of ursodeoxycholic acid is effective and safe in the treatment of patients with cholestasis gravidarum.
Keywords: Pruritus; Jaundice; Fetal Distress; Evidence-BASED Decisions.
RESUMEN
Introducción: la Colestasis gravídica es un síndrome que habitualmente se produce en mujeres embarazadas en el segundo o tercer trimestre de gestación y que termina en el puerperio. Se caracteriza clínicamente por la presencia de prurito de predominio nocturno que al principio es palmo - plantar y luego generalizado. Alteraciones en la función hepática con o sin ictericia y niveles elevados de ácidos biliares séricos, la colestasis bioquímica se clasifica de leve a moderada severidad.
Objetivo: métodos de diagnósticos y conductas en sus tratamientos farmacológicos que brindan los mejores resultados a dichas pacientes.
Métodos: revisión sistemática utilizando los términos MESH (cholestasis of pregnancy) que generaron 2597 resultados.
Resultados: se analizaron con más detalle 28 artículos, de los cuales quedaron finalmente seleccionados 12 artículos para el análisis final. Tratamiento: El ácido ursodesoxicólico (UDCA), un epímero beta del ácido quenodesoxicólico, es un ácido biliar más polar que los ácidos biliares primarios, con efectos coleréticos sustanciales y otros múltiples efectos quimioprotectores. El mecanismo de acción no se comprende por completo, pero los estudios han demostrado que después del tratamiento se produce una reducción de los ácidos biliares séricos totales tanto en el suero materno como en el del cordón umbilical y un cambio cualitativo en la reserva de ácidos biliares séricos. Cuando se comparó con todos los controles, también se encontró que el UDCA se asoció con una disminución de la incidencia de nacimientos prematuros, dificultad respiratoria neonatal y del número de internaciones de neonatos en las unidades de cuidados intensivos.
Conclusiones: el tratamiento de la colestasis gravídica es la administración oral de ácido ursodesoxicólico, es eficaz y seguro en el tratamiento de pacientes con colestasis gravídica.
Palabras clave: Prurito; Ictericia; Distress Fetal; Decisiones Basadas En La Evidencia.
INTRODUCCIÓN
La colestasis intrahepática del embarazo es un trastorno colestásico caracterizado clínicamente por la presencia de prurito, aminotransferasas séricas elevadas y niveles elevados de ácidos biliares que comienza en el segundo o tercer trimestre de la gestación y es espontáneo, donde desaparecen cuando finaliza el embarazo.
Es una enfermedad multifactorial, donde intervienen principalmente factores genéticos y hormonales, teniendo en cuenta otros factores de riesgo como ambiental, dietético y raza. La madre no tiene ninguna complicación con la enfermedad, pero ocurren complicaciones fetales, que tienen riesgos de prematuridad y muerte intrauterina.
La incidencia de la colestasis intrahepática del embarazo varía con la localización geográfica y la raza. Las mayores tasas de incidencia se han encontrado en Chile (en raza india), su incidencia es variable y oscila entre 1/300 y 1/2000.(1,2)
En los países escandinavos y bálticos, la colestasis gravídica se produce en hasta el 2 % de todos los embarazos, mientras que, en otras regiones de Europa, Asia, América del Norte y Australia, la incidencia notificada es inferior al 1 %. Si bien la incidencia ha disminuido recientemente en las regiones de alta incidencia, aumentó en las áreas de baja incidencia, lo que posiblemente refleja la mayor concienciación sobre la enfermedad. La colestasis gravídica es más común en los meses de invierno en Chile, y en embarazos gemelares y múltiples.(3,4)
Los síntomas se resuelven rápidamente después del parto, acompañados de la normalización de las pruebas hepáticas séricas. Las anomalías persistentes deben hacer que se reconsideren otras enfermedades hepáticas crónicas subyacentes, como la cirrosis biliar primaria, la colangitis esclerosante primaria o la hepatitis C crónica, que pueden estar asociadas con el desarrollo de prurito al final del embarazo. La colestasis gravídica reaparece durante los embarazos posteriores en el 45-70 % con episodios recurrentes de gravedad variable.(3)
La colestasis gravídica aumenta el riesgo de parto prematuro (hasta un 19-60 %), tinción meconial del líquido amniótico (hasta un 27 %), bradicardia fetal (hasta un 14 %), sufrimiento fetal (hasta 22–41 %) y pérdida fetal (hasta 0,4–4,1 %), particularmente cuando se asocia con niveles séricos de ácidos biliares en ayunas > 40 μmol/ L. Los niveles séricos de ácidos biliares en ayunas y la gravedad del prurito en el momento del diagnóstico fueron predictores independientes de parto prematuro en un análisis reciente. Curiosamente, los datos más recientes muestran una marcada disminución de las complicaciones fetales, posiblemente en parte debido a una mayor conciencia de la enfermedad, un seguimiento más estrecho y un manejo experimentado en centros especializados. Las autopsias de los mortinatos muestran signos de anoxia aguda con hemorragia petequial serosa y pulmonar sin retraso del crecimiento intrauterino. La patogenia de las complicaciones fetales aún no se conoce bien, aunque se ha sugerido un papel de los ácidos biliares o de los metabolitos tóxicos de los ácidos biliares. Se demostró que los ácidos biliares inducen la contracción de las venas coriónicas de la placenta, y la sensibilidad miometrial de las mujeres sanas a la oxitocina aumentó después de la incubación con ácido cólico. La infusión de ácido cólico en fetos de cordero estimula la motilidad del colon aumentando la incidencia de paso de meconio. En un estudio prospectivo de colestasis gestacional en pacientes con niveles de ácidos biliares > 40 μmol/L, la frecuencia de eliminación de meconio fue del 44 % en comparación con el 22 % en un grupo con solo colestasis gestacional leve.(3,5)
En general, la colestasis corresponde a todas las manifestaciones ligadas a la reducción o cese de la secreción biliar. Dependiendo de su mecanismo, la colestasis se denomina extrahepática o intrahepática. La colestasis extrahepática está relacionada con la obstrucción de las vías biliares extrahepáticas, por ejemplo, por un tumor o un cálculo. La colestasis intrahepática es vinculado a una obstrucción de los conductos biliares intrahepáticos o a una reducción en la secreción de bilis debido al daño a los hepatocitos. La colestasis intrahepática del embarazo en sí está ligada a una disminución en la secreción de ciertos componentes de la bilis por parte de los hepatocitos. De hecho, es una enfermedad multifactorial, con factores principalmente hormonales y genéticos. Los factores ambientales y dietéticos también pueden modular la expresión de la enfermedad.(1)
La mayoría de los datos relacionados con las influencias genéticas en la colestasis provienen de la investigación de la colestasis intrahepática familiar progresiva (PFIC). PFIC es un trastorno hepático progresivo que resulta de la acumulación de bilis en las células hepáticas que eventualmente conduce a insuficiencia hepática. Si bien este trastorno no es específico del embarazo, los fundamentos genéticos de la enfermedad resaltan los factores de riesgo genéticos que pueden predisponer a la colestasis del embarazo. PFIC se clasifica en 3 subtipos, cada uno causado por una mutación genética diferente que resulta en una proteína transportadora de ácidos biliares defectuosa. Esas mutaciones genéticas ocurren en el ATP8B1 gen (subtipo 1), el ABCB11 gen (subtipo 2), y el ABCB4 gen (subtipo 3). Un estudio prospectivo sueco de 693 mujeres con ICP grave (niveles de ácidos biliares≥40 μmol/L) mostró un aumento de la variante genética ABCB4 en pacientes afectados. Las variaciones genéticas en el FXR, codificadas por el gen NR1H4, también se han relacionado con la colestasis en el embarazo. Además, hay pocos datos que sugieren que los niveles reducidos de selenio y vitamina D juegan un papel potencial. Por último, los estudios basados en la población han relacionado varias enfermedades hepáticas crónicas con el desarrollo de colestasis intrahepática, a saber, la infección por hepatitis C.(5,6)
Los cambios metabólicos maternos son clave para un embarazo exitoso. Sin embargo, estas adaptaciones pueden volverse patológicas en individuos genéticamente susceptibles, resultando en colestasis gestacional o diabetes mellitus. Por lo tanto, otro componente para comprender la etiología de la colestasis es el papel de las hormonas reproductivas. Con respecto a la colestasis, los niveles séricos de estrógeno y progesterona son más altos durante el tercer trimestre, cuando la enfermedad suele presentarse. Varios estudios con roedores han mostrado un efecto colestásico de la administración de estrógenos, con efectos observados en la expresión y localización del transportador. Los estudios de perfiles de expresión hepática utilizando micromatrices en ratones knockout para FXR en comparación con controles embarazadas indicaron cambios similares, lo que sugiere una desensibilización de la vía FXR en el embarazo normal e in vitrolos estudios indican que esto puede ser dependiente de los estrógenos. Recientemente se demostró que FXR puede ser inhibido directamente por el receptor de estrógeno activado por 17-estradiol, lo que da como resultado una inhibición de la transcripción de ABCB11. Además de los estrógenos, la progesterona tiene una importancia considerable en la etiología de la patología. En particular, varios metabolitos de progesterona han sido identificados como capaces de interactuar con las vías de señalización de los ácidos biliares, lo que tiene un impacto en el fenotipo colestásico. Estos metabolitos se elevan en el embarazo normal y se elevan aún más en la colestasis gestacional. Se ha demostrado que afectan la entrada de ácidos biliares hepatocelulares mediante la inhibición competitiva de NTCP y reducen la salida mediada por BSEP. Ciertos metabolitos también actúan como agonistas parciales de FXR, lo que contribuye al fenotipo colestásico al desensibilizar las vías reguladas por FXR. Además, los metabolitos específicos pueden servir como biomarcadores predictivos tempranos, ya que se elevan antes del aumento de los ácidos biliares séricos.(7)
Hay una tasa más alta de la colestasis gravídica en Chile en invierno cuando los niveles de selenio materno son más bajos. En la década entre 1990 y 2000, a medida que aumentaron los niveles de selenio sérico de mujeres no embarazadas en Chile, la tasa disminuyó. Un artículo de 2012 que examina el papel del selenio en la salud reproductiva reveló que el selenio se encuentra en concentraciones más altas en los alimentos vegetales, particularmente en el trigo. También se encuentra en la carne, las aves y el pescado. El contenido de selenio de los alimentos depende de su contenido y disponibilidad en el suelo donde crecen las plantas y pastan los animales. Se ha observado deficiencia de selenio en personas que viven en regiones donde hay actividad volcánica como Chile y Finlandia; el suelo es ácido y mal aireado; por lo tanto, el selenio está presente en el selenito, un complejo insoluble. Se encontró que las mujeres finlandesas y chilenas con ICP tenían una actividad sérica de selenio y glutatión peroxidasa disminuida en comparación con mujeres embarazadas sanas. Los niveles de selenio en plasma se miden mediante espectrometría de masas de plasma, que es muy precisa. También se puede medir en sangre entera, orina, líquido amniótico, cabello y uñas de los pies.(5)
Hay 6 tipos de glutatión peroxidasas. Son selenoproteínas y antioxidantes, que tienen un efecto vital sobre las funciones hormonales, inmunológicas e inflamatorias. El glutatión peroxidasas mantienen la estabilidad de la membrana celular, protegen la producción de prostaciclina, que es antiinflamatoria, y protegen los lípidos, las lipoproteínas y el ADN de los efectos dañinos de la oxidación. Su mecanismo de acción es la reducción del peróxido de hidrógeno y los peróxidos lipídicos, 2 subproductos de la oxidación celular, a agua y alcoholes inocuos. En la última década en Chile, la incidencia de patología ha disminuido en mujeres embarazadas, ya que los niveles de selenio sérico han aumentado debido a la suplementación del suelo y la alimentación del ganado. Se plantea la hipótesis de que, con la deficiencia de selenio en el embarazo, su propiedad antioxidante se ve comprometida, lo que da como resultado una acumulación de sales biliares citotóxicas en el hepatocito que finalmente se derraman en la circulación materna y fetal y provocan las secuelas de la colestasis gravídica.(2)
Cuando una mujer embarazada se presenta para atención prenatal y está experimentando prurito, una historia y un examen físico, ayudarán con el diagnóstico. Los componentes para considerar incluyen los siguientes:
· La edad gestacional junto con el inicio y la severidad del prurito.
· Antecedentes de exposición nueva o reciente a alérgenos como jabones, lociones, detergentes y alimentos.
· Antecedentes de síntomas acompañantes como náuseas, vómitos, diarrea, dolores de cabeza, alteraciones visuales, malestar general, dolor epigástrico u otro dolor abdominal.
· Estos síntomas pueden estar relacionados con enfermedades virales, trastornos de la vesícula biliar o hipertensión inducida por el embarazo.
· Signos vitales con especial atención a la tensión arterial. Una elevación puede estar relacionada con la hipertensión inducida por el embarazo.
· Examen cuidadoso de la piel en busca de erupciones, lesiones, excoriaciones o ictericia.
· Un examen abdominal completo, notando cualquier sensibilidad o dolor, incluyendo sensibilidad de rebote o defensa. Un examen anormal puede estar relacionado con un trastorno de la vesícula biliar o del hígado o una posible apendicitis.
· Percusión de los márgenes del hígado para determinar si el hígado está agrandado. La forma y la consistencia del hígado se determinan mediante palpación. Un examen anormal puede sugerir una enfermedad hepática aguda o crónica2.
El síntoma principal, presente en aproximadamente el 95 % de los casos, es el prurito que aparece con mayor frecuencia en el tercer trimestre, más raramente en el segundo trimestre en formas más severas. El prurito es aislado sin dolor ni fiebre. El prurito suele ser generalizado pero lo más frecuente es que predomine en las extremidades, a nivel de las palmas de las manos y las plantas de los pies. Ocasional al principio, puede convertirse rápidamente en permanente (diurna y nocturna) y ser responsable de irritabilidad, astenia e incluso insomnio. La intensidad del prurito se puede cuantificar (posiblemente por los propios pacientes) mediante una puntuación de 0 a 4 (0, sin prurito; 1, prurito ocasional (no diario); 2, prurito moderado (diario e intermitente, con mayoría de prurito asintomático); 3, prurito intenso (diario e intermitente, con una mayoría de períodos sintomáticos); 4, prurito permanente día y noche). El prurito suele desaparecer en los días siguientes al parto, a veces nada más despertar tras una cesárea. Aparte de las lesiones por rascado secundarias al prurito, no hay lesión cutánea, a diferencia de lo que se observa en las dermatosis pruriginosas del embarazo. La ictericia puede acompañar al prurito en 10 a 20 % de los casos; en este caso la ictericia aparece después del prurito. Las formas ictéricas sin prurito son excepcionales. Puede haber esteatorrea mínima secundaria a malabsorción de grasas con deficiencia de vitamina K, lo que aumenta el riesgo de hemorragia posparto.(3,2)
Las principales alteraciones bioquímicas son las elevaciones de los ácidos biliares séricos y las actividades de las aminotransferasa. Los niveles séricos de ácidos biliares totales pueden aumentar de 10 a 100 veces por encima del rango normal y se observaron tasas más altas de complicaciones fetales con niveles de ácidos biliares maternos en ayunos superiores a 40 μmol/L. En la ICP, el ácido cólico aumenta más que el ácido quenodesoxcólico con un aumento en la proporción molar habitual de cólico sérico a ácido quenodesoxcólico, mientras que la proporción de ácidos biliares conjugados con glicina y taurina disminuye. De interés, un subgrupo de mujeres embarazadas sanas asintomáticas con ácidos biliares séricos totales por encima del límite superior normal de 11 μM al final de la gestación y pruebas hepáticas séricas normales se ha definido recientemente como hipercolanemia asintomática del embarazo (AHP). La composición de ácidos biliares séricos de mujeres con CIE reveló un cambio hacia un patrón más hidrofóbico con niveles más altos de ácido litocólico y ácidos biliares séricos no conjugados, lo que sugiere que estas alteraciones podrían ser parámetros útiles adicionales en el diagnóstico diferencial de CIE y AHP. En suero las aminotransferasas también están elevadas de 2 a 10 veces por encima de lo normal en el 20 al 60 % de los pacientes con prurito, y pueden superar las 1000 U/L en casos excepcionales. Las aminotransferasas séricas pueden permitir un mejor seguimiento de los pacientes con CIE después del inicio del tratamiento con UDCA que los niveles séricos totales de ácidos biliares en ayunas que inicialmente aumentan debido a un aumento en los niveles séricos de ácido ursodesoxicólico (UDCA). Las concentraciones séricas de gamma glutamil transpeptidasa son normales o ligeramente elevadas en la mitad de los pacientes, y alcanzan hasta cuatro veces los límites normales superiores. Los niveles séricos de fosfatasa alcalina pueden aumentar hasta 7-10 veces lo normal, pero son difíciles de interpretar debido a la elevación de la isoenzima placentaria.(4,8)
Una concentración sérica elevada de ácidos biliares es un requisito para el diagnóstico. Los ácidos biliares totales a menudo se informan como una suma de todos los ácidos biliares, incluidos los ácidos cólicos, quenodesoxicólico, desoxicólico, ursodesoxicólico, litocólico e hiodesoxicólico. Sin embargo, los ácidos biliares humanos primarios son el ácido cólico y el quenodesoxicólico y los ácidos biliares restantes se encuentran en cantidades muy pequeñas tanto en pacientes normales como con colestasis intrahepática gestacional (PIC). En mujeres sanas no embarazadas, los niveles de ácido quenodesoxicólico en suero son más altos que los niveles de ácido cólico. En mujeres con PIC, el ácido cólico es mucho mayor que el ácido quenodesoxicólico, a menudo en una proporción de 3 a 1. Tradicionalmente, los ácidos biliares séricos se midieron mediante espectroscopia de masas en tándem de cromatografía líquida, que permite informar sobre especies de ácidos biliares individuales. Sin embargo, la mayoría de los hospitales no utilizan este método y la necesidad de realizar pruebas de envío puede ir acompañada de retrasos potencialmente prolongados en los resultados y, por lo tanto, en el diagnóstico. Un método alternativo implica ensayos enzimáticos de ácidos biliares y técnicas convencionales basadas en placas inmunoabsorbentes. Estos ensayos se pueden realizar de forma rápida y económica en muchos hospitales y laboratorios comerciales. Una limitación de esta técnica es la incapacidad de informar sobre especies específicas de ácidos biliares. Algunos médicos han abogado por el uso de una relación entre ácido cólico y quenodesoxicólico para aumentar la especificidad en el diagnóstico de la PIC. Sin embargo, es importante saber qué ácidos biliares se miden en un ensayo específico, ya que ciertos medicamentos que contienen ácidos biliares exógenos, por ejemplo, UDCA exógeno y remedios caseros que contienen bilis animal, pueden aumentar los niveles totales de ácidos biliares medidos mediante un ensayo inclusivo.(6)
A pesar de las controversias de las autoridades de la especialidad de obstetricia oficiales, el fármaco recomendado en el tratamiento de la patología es la administración oral de ácido ursodesoxicólico (UDCA), según las directrices recientes de la Asociación Europea para el Estudio de las Enfermedades Hepáticas. Esta recomendación está respaldada por evidencia publicada recientemente que sugiere múltiples beneficios para los fetos y los recién nacidos. El UDCA, un epímero beta del ácido quenodesoxicólico, es un ácido biliar más polar que los ácidos biliares primarios, con efectos coleréticos sustanciales y otros múltiples efectos quimioprotectores.(8,9)
El ácido ursodesoxicólico afecta las sales biliares de 3 maneras. En primer lugar, reduce los niveles séricos maternos de sales biliares tóxicas y bilirrubina al aumentar su secreción biliar. En segundo lugar, protege a los colangiocitos de las sales biliares citotóxicas. En tercer lugar, protege a los hepatocitos de la apoptosis (muerte celular programada). Las dosis varían de 500 mg a 2 g por vía oral por día, ajustadas a los síntomas, y la reducción de los valores de sales biliares séricas maternas. El ácido ursodesoxicólico es bien tolerado por las mujeres embarazadas y solo se informan efectos secundarios leves de diarrea y náuseas.(2,10)
El mecanismo de acción no se comprende por completo, pero los estudios han demostrado que después del tratamiento se produce una reducción de los ácidos biliares séricos totales tanto en el suero materno como en el del cordón umbilical y un cambio cualitativo en la reserva de ácidos biliares séricos. Un metanálisis reciente de BACQ ET AL, demostraron que, en un análisis combinado, el UDCA se asoció con la resolución total del prurito y disminución de ALT, AST y niveles de ácidos biliares en comparación con todos los controles (placebo, colestiramina, dexametasona, S-adenosilmetionina o ningún tratamiento), este metanálisis sugiere que puede haber algún beneficio fetal con el tratamiento. Cuando se comparó con todos los controles, también se encontró que el UDCA se asoció con una disminución de la incidencia de nacimientos prematuros, dificultad respiratoria neonatal y del número de internaciones de neonatos en las unidades de cuidados intensivos. Sin embargo, cuando se comparó UDCA con placebo (solo aquellos pacientes que recibieron un tratamiento con placebo en comparación con todos los controles), no se observaron diferencias en los resultados o desenlaces neonatales.(4,5,11)
MÉTODOS
Para esta revisión sistemática se realizó una búsqueda por la base de datos de PubMed, utilizando los siguientes términos MeSH: cholestasis of pregnancy. Con los resultados de tal búsqueda se confeccionó una tabla de EXCEL con 32 artículos, que posteriormente a una selección criteriosa basada en los criterios de inclusión y exclusión, se hallaron 12 artículos seleccionables a los fines del estudio. En esta tabla fueron señalados con “SI o NO” los artículos que serían o no utilizados para un posterior análisis en la presente revisión sistemática. En esta revisión sistemática fueron incluidos los artículos que cumplían los criterios de inclusión (pacientes mujeres embarazadas en el segundo y tercer trimestre, ingresada en cualquier unidad asistencial con colestasis gravídica e sus formas de tratamiento), y también los criterios de exclusión (pacientes con patologías preexistente, embarazo en el primer trimestre, raza africana y europea). Con eso, se respondió la pregunta PICO (¿En pacientes embarazadas que padecen de colestasis intrahepática, que fármacos han mostrado beneficio en el tratamiento de esta entidad?). Al final de todo el proceso quedaron 12 artículos para la pesquisa final. En esta revisión sistemática fueron utilizadas variables de tipo cuantitativa (epidemiologia, resultados a nivel fetales, resultados a nivel materno) y cualitativa (embarazos en el segundo y tercer trimestre, tratamiento con ácido ursodesoxicólico). Como se puede observar en el flujograma (figura 1), el total de artículos en la búsqueda fueron 32 artículos, y al final de la investigación quedaron 12 artículos para analizar y realizar la revisión sistemática.
|
Identificación |
|
Estudios identificados con los filtros, criterios de inclusión y exclusión aplicados (n=32) |
→ |
Artículos duplicados excluidos (n=8) |
|
|
|
↓ |
|
|
|
Selección |
|
Artículos seleccionados para leer títulos y resúmenes (n=24) |
→ |
Artículos eliminados por el título o resumen (n=5) Artículos eliminados por ser estudios en zonas no epidémicas o embarazos del primer trimestre (n=4) Artículos eliminados por no relacionarse al objetivo investigado (n=4) |
|
|
|
↓ |
|
|
|
Inclusión |
|
Documentos incluidos en la selección (n=11) |
|
|
Figura 1. Flujograma de inclusión y exclusión de artículos
RESULTADOS
Entre los 11 artículos, se encontró que, aunque la colestasis gravídica es una enfermedad benigna, es necesario que los obstetras utilicen medicamentos eficaces para aliviar la sintomatología, ya que el prurito afecta la calidad de vida de las mujeres embarazadas. Como conclusión, el uso de ácido ursodesoxicólico (UDCA) representa un avance en el manejo de mujeres que presentan colestasis gravídica en el embarazo, pero todavía se necesitan estudios para especificar los métodos de administración, su dosificación y duración del tratamiento. Entretanto, debido a la reducción de la prematuridad espontánea y la mejora de los signos de colestasis gracias al tratamiento médico, la cuestión del manejo obstétrico a adoptar al final del embarazo se torna crucial. Actualmente, los mecanismos del tratamiento de UDCA en enfermedades hepáticas colestáticas no están completamente revelados. Los posibles mecanismos son los siguientes: restaurar el metabolismo normal del hígado; fortalecer el transporte de ácidos biliares a través de la placenta hacia el feto para disminuir la acumulación de ácidos biliares; proteger la célula hepática de la toxicidad de los ácidos biliares; aumentar la superficie de organización del transporte (p. ej., vellosidades terminales, vasodilatador); prevenir el estrés oxidativo y la apoptosis10.
La administración de UDCA da como resultado una mejora del prurito en un 60 % de las mujeres y el cese completo del prurito en un 40 %, donde la mejoría de los síntomas generalmente se observa dentro de 1 a 2 semanas después del inicio de su administración farmacológica y una disminución de los ácidos biliares séricos 2 semanas después, pero el resultado final del tratamiento es cuando finaliza el embarazo (figura 2).
El UDCA puede reducir la incidencia de trabajo de parto prematuro, sufrimiento fetal y síndrome de dificultad respiratoria neonatal, donde los resultados observados pueden guiar a los obstetras en el manejo de la PIC.
Existen artículos que indican que el uso de otros fármacos combinados produce un efecto benéfico para disminuir los síntomas de la paciente, como el uso de dexametasona, que mejora los síntomas y los niveles totales de bilis, favorece una maduración fetal, pero solo con recomendación del obstetra.
La rifampicina en su uso como agente de segunda línea en pacientes cuyos síntomas no responden a UDCA, sugiere que es un tratamiento eficaz, para la cirrosis biliar primaria, y en otro orden la vitamina K en ocasiones se prescribe de manera profiláctica para proteger contra el riesgo teórico de sangrado relacionado con la deficiencia de vitamina K secundaria a la esteatorrea, y finalmente los suplementos de vitamina K pueden reducir el riesgo de posparto hemorragia o hemorragia neonatal.
En conclusión, el tratamiento de la colestasis gravídica es la administración oral de ácido ursodesoxicólico, es eficaz y seguro en el tratamiento de pacientes con colestasis gravídica.
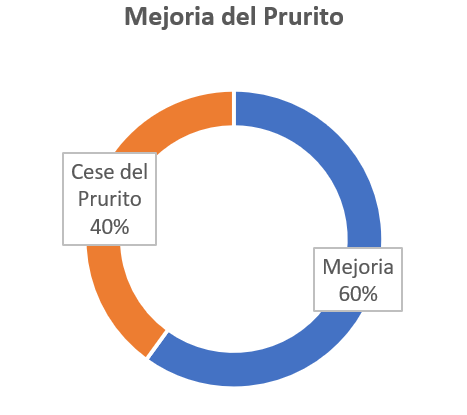
Figura 2. Mejoría del prurito con administración oral de ácido ursodesoxicólico; de los síntomas generalmente se observa dentro de 1 a 2 semanas después del inicio de su administración farmacológica y una disminución de los ácidos biliares séricos 2 semanas después
DISCUSIÓN
El UDCA es el fármaco más eficaz para curar la PIC, pero no hay pruebas suficientes para recomendar el UDCA solo o en combinación con otros fármacos para tratar a las mujeres con PIC. No hay evidencia de efectos positivos para los pacientes con PIC por tomar UDCA, se necesitaban más investigaciones. Los datos mostraron un beneficio significativo de UDCA para mejorar los síntomas de prurito maternos y funciones hepáticas (ALT, ácidos biliares, bilirrubina). No existieron diferencias significativas en cuanto a la cesárea. También se encontró que UDCA reduce significativamente el riesgo de desenlaces adversos fetales y neonatales (excluyendo IUGR y tinción de meconio). Estos resultados respaldan los hallazgos de otros.(10,12,13)
CONCLUSIONES
La colestasis gravídica, aunque no suele ser grave, provoca picazón intensa en mujeres embarazadas, afectando su bienestar. El tratamiento con ácido ursodesoxicólico (UDCA) ha mostrado eficacia al aliviar el prurito en un 60 % y eliminarlo en un 40 % de las pacientes en 1-2 semanas, con una disminución de ácidos biliares séricos. Además, UDCA parece reducir el riesgo de parto prematuro y complicaciones neonatales. Combinarlo con otros fármacos como la dexametasona puede ser útil bajo supervisión médica. Aunque es seguro, se requieren más estudios para definir su dosificación y duración ideales, así como para comprender completamente sus mecanismos de acción.
REFERENCIAS BIBLIOGRÁFICAS
1. Sentilhes, L.; Bacq, Y. La cholestase intrahépatique gravidique. Journal de Gynécologie Obstétrique et Biologie de la Reproduction 2008, 37 (2), 118–126. https://doi.org/10.1016/j.jgyn.2006.09.007.
2. Gabzdyl, E. M.; Schlaeger, J. M. Intrahepatic Cholestasis of Pregnancy: A Critical Clinical Review. Journal of Perinatal & Neonatal Nursing 2015, 29 (1), 41–50. https://doi.org/10.1097/JPN.0000000000000077.
3. Pusl, T.; Beuers, U. Intrahepatic Cholestasis of Pregnancy. Orphanet J Rare Dis 2007, 2 (1), 26. https://doi.org/10.1186/1750-1172-2-26.
4. Shao, Y.; Chen, S.; Li, H.; Tang, Q.; Xu, D. Maternal Bile Acid Profile and Subtype Analysis of Intrahepatic Cholestasis of Pregnancy. Orphanet J Rare Dis 2021, 16 (1), 259. https://doi.org/10.1186/s13023-021-01887-1.
5. Carballo Flores R. Application of the TRIPS score in neonates requiring interhospital transfer. Interdisciplinary Rehabilitation / Rehabilitacion Interdisciplinaria. 2021;1:5. https://doi.org/10.56294/ri20215
6. Wood, A. M.; Livingston, E. G.; Hughes, B. L.; Kuller, J. A. Intrahepatic Cholestasis of Pregnancy: A Review of Diagnosis and Management. Obstetrical & Gynecological Survey 2018, 73 (2), 103–109. https://doi.org/10.1097/OGX.0000000000000524.
7. Smith, D. D.; Rood, K. M. Intrahepatic Cholestasis of Pregnancy. Clinical Obstetrics & Gynecology 2020, 63 (1), 134–151. https://doi.org/10.1097/GRF.0000000000000495.
8. Dixon, P. H.; Williamson, C. The Pathophysiology of Intrahepatic Cholestasis of Pregnancy. Clinics and Research in Hepatology and Gastroenterology 2016, 40 (2), 141–153. https://doi.org/10.1016/j.clinre.2015.12.008.
9. Bicocca, M. J.; Sperling, J. D.; Chauhan, S. P. Intrahepatic Cholestasis of Pregnancy: Review of Six National and Regional Guidelines. European Journal of Obstetrics & Gynecology and Reproductive Biology 2018, 231, 180–187. https://doi.org/10.1016/j.ejogrb.2018.10.041.
10. Šimják, P.; Pařízek, A.; Vítek, L.; Černý, A.; Adamcová, K.; Koucký, M.; Hill, M.; Dušková, M.; Stárka, L. Fetal Complications Due to Intrahepatic Cholestasis of Pregnancy. Journal of Perinatal Medicine 2015, 43 (2). https://doi.org/10.1515/jpm-2014-0089.
11. Kong, X.; Kong, Y.; Zhang, F.; Wang, T.; Yan, J. Evaluating the Effectiveness and Safety of Ursodeoxycholic Acid in Treatment of Intrahepatic Cholestasis of Pregnancy: A Meta-Analysis (a Prisma-Compliant Study). Medicine 2016, 95 (40), e4949. https://doi.org/10.1097/MD.0000000000004949.
12. Miana VV. Relevance of the learning provided by the field of research for academic training in surgical instrumentation. Interamerican Journal of Health Sciences. 2022;(2):111. https://doi.org/10.59471/ijhsc2022111
13. Shao, Y.; Chen, S.; Li, H.; Tang, Q.; Xu, D. Maternal Bile Acid Profile and Subtype Analysis of Intrahepatic Cholestasis of Pregnancy. Orphanet J Rare Dis 2021, 16 (1), 259. https://doi.org/10.1186/s13023-021-01887-1.
FINANCIACIÓN
No existe financiación para el presente trabajo
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de interés
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Lorran Nobre Da Silva, Marcelo Adrian Estrin.
Investigación: Lorran Nobre Da Silva, Marcelo Adrian Estrin.
Metodología: Lorran Nobre Da Silva, Marcelo Adrian Estrin.
Administración del proyecto: Lorran Nobre Da Silva, Marcelo Adrian Estrin.
Redacción-borrador original: Lorran Nobre Da Silva, Marcelo Adrian Estrin.
Redacción-revisión y edición: Lorran Nobre Da Silva, Marcelo Adrian Estrin.