doi: 10.56294/dm2023346
REVISIÓN BIBLIOGRÁFICA
Characterization of Trichinella spiralis and its incidence in Ecuador
Caracterización de la Trichinella spiralis y su incidencia en Ecuador
Melany Michelle Abril Moya1 ![]() *, Graciela Alexandra Carrera Aldaz1
*, Graciela Alexandra Carrera Aldaz1 ![]() *, Francisco Xavier
Poveda Paredes1
*, Francisco Xavier
Poveda Paredes1 ![]() *
*
1Universidad Regional Autónoma de Los Andes, Sede Ambato, Ecuador.
Citar como: Abril Moya MM, Carrera Aldaz GA, Poveda Paredes FX. Characterization of Trichinella spiralis and its incidence in Ecuador. Data and Metadata. 2023; 2:346. https://doi.org/10.56294/dm2023346
Enviado: 16-06-2023 Revisado: 24-09-2023 Aceptado: 21-12-2023 Publicado: 22-12-2023
Editor: Adrián
Alejandro Vitón Castillo ![]()
ABSTRACT
Trichinella spiralis is a parasite that can infect humans through consumption of infected raw or undercooked meat, especially pork, wild boar, bear and other wild animals. Trichinella infection can cause a disease called trichinosis, which can result in serious symptoms such as fever, muscle pain, facial and eye swelling, and in severe cases, cardiac and respiratory complications. The main objective of this research is to characterize the pathogenicity mechanisms of Trichinella spiralis and its incidence in Ecuador through a bibliographic review. A bibliographic review of a retrospective descriptive narrative type was carried out. Trichinella spiralis infection has a suppressive effect on the immune system, making it totally invisible to invasive elimination attacks. The parasite, as its life cycle progresses, changes its morphology and excretion, which allows it to migrate with lymph or blood, invading skeletal muscle. The lack of mechanisms for detecting Trichinella in pork and monitoring safe meat handling and cooking practices constitute a food safety problem in Ecuador. The specific incidence in humans of Trichinella spiralis in Ecuador is not widely documented in scientific literature or public health sources. However, although trichinosis is a parasitic disease that is not very common in Ecuador, it is necessary for health professionals to be attentive to this problem and work together to implement effective control and prevention strategies.
Keywords: Trichinosis; Parasite; Pathogenicity; Animal Health.
RESUMEN
Trichinella spiralis es un parásito que puede infectar a los seres humanos a través del consumo de carne cruda o poco cocida infectada, especialmente carne de cerdo, jabalí, oso y otros animales salvajes. La infección por Trichinella puede causar una enfermedad llamada triquinosis, que puede resultar en síntomas graves como fiebre, dolor muscular, hinchazón facial y ocular, y en casos severos, complicaciones cardíacas y respiratorias. El objetivo principal de esta investigación es caracterizar los mecanismos de patogenicidad de la Trichinella spiralis y su incidencia en Ecuador mediante una revisión bibliográfica. Se realizó una revisión bibliográfica de tipo narrativo descriptivo de carácter retrospectivo. La infección de Trichinella spiralis, tienen un efecto de supresión al sistema inmunitario, haciéndolo totalmente invisible ante ataques invasivos de eliminación. El parásito, conforme avanza su ciclo de vida, cambia su morfología y excreción, lo que le permite migrar con linfa o sangre, invadiendo el músculo esquelético. La falta de mecanismos de detección de Trichinella en la carne porcina y de seguimiento de las prácticas seguras de manipulación y cocción de la carne constituyen un problema de seguridad alimentaria en Ecuador. La incidencia específica en humanos de Trichinella spiralis en Ecuador no está ampliamente documentada en la literatura científica ni en fuentes de salud pública. No obstante, a pesar de que la trichinosis es una enfermedad parasitaria no muy frecuente en Ecuador es necesario que los profesionales de la salud estén atentos a esta problemática y trabajen de manera conjunta para implementar estrategias de control y prevención efectivas.
Palabras clave: Trichinelosis; Parásito; Patogenicidad; Sanidad Animal.
INTRODUCCIÓN
Trichinella spiralis es una parásito intracelular que se caracteriza por tomar el lugar de la célula anfitriona, sin necesidad de aniquilarla. Es un nemátodo, caracterizado por ser un gusano redondo del tubo digestivo. Su estructura anatómica radica en la parte frontal de su cuerpo, que da lugar a un estilete y un esticosoma. Por otro lado, su parte dorsal se caracteriza por ser redondeada.(1)
Este parásito es distintivo debido a que presenta diferenciación biológica en hembra y macho. La hembra mide de 3 a 4 milímetros de longitud y unas 60 micras de diámetro. Los machos miden, en promedio, la mitad que la hembra y en el extremo dorsal se evidencia dos apéndices caudales lobulares. Se llega a transmitir entre animales, así como también en seres humanos a animales, a lo que se denomina zoonosis.(2,3)
La transmisión de este parásito se produce por la ingesta de carne cruda o poco cocinada de animales infectados con larvas de este. En el caso de los humanos, frecuentemente del cerdo. La célula infectada lleva a cabo su propio ciclo biológico en su hospedador, y da inicio cuando las larvas enquistadas están en la carne, y se ingieren.(1,4)
Una vez en el intestino delgado del hospedador empieza su función de absorción y movimientos peristálticos, las larvas se liberan y los machos llegan a morir, a diferencia de las hembras quienes ingresan en la mucosa intestinal y sitúan de 500 a 1000 larvas. Las nuevas larvas transitan a través de la sangre o de la linfa hacia otros órganos o tejidos del hospedador. Sin embargo, su crecimiento solo se produce en la musculatura estriada del hospedador (músculos mandibulares, oculares, deltoides, lengua, etc.) dado que, en estas estructuras gran parte de las especies se encapsulan formando un quiste. En el interior del quiste la larva puede permanecer viva durante años.(5)
El parásito Trichinella spiralis es el agente que causa la trichinelosis o triquinosis, la cual es una zoonosis parasitaria. En comparación con los cerdos, en los seres humanos las infecciones con T. spiralis presentan lesiones graves a nivel intestinal, inflamación, fiebre, diarrea, edemas y dolor a nivel muscular. T. spiralis incluye tres fases o estadios: una fase enteral o estadio gastrointestinal, asociada a los signos y síntomas gastrointestinales, en donde el parásito mudo y pasa a ser adulto. Una fase parenteral o estadio de invasión a los tejidos, asociada a los síntomas extragastrointestinales, que corresponde a una larva recién nacida. Y, por último, la fase muscular o estadio de convalecencia, privativo del origen de un enquistamiento.(6)
Mientras ocurre la fase parenteral se produce un proceso de migración larvaria, el cual inicia en el tubo digestivo por vía sanguínea; en donde se enquistan en el músculo esquelético, pero el daño ocasionado a nivel vascular puede derivar en una afectación a otros órganos.(1,4)
El ciclo biológico de la Trichinella spiralis se caracteriza por ser el único que tiene un desarrollo en todos sus estadios. Mantiene una exclusividad en su manera de propagación hacia el ser humano, ya que solamente se da si se ingiere carne cruda o mal cocinada procedente de animales domésticos o salvajes que sean portadores de la enfermedad. Muchos de los cuales son asintomáticos.(6,7)
Una vez infectado el huésped, las larvas son liberadas, gracias a la pepsina y el HCl del estómago, mismas que se traspasan al intestino delgado, alojándose en las microvellosidades de células epiteliales. El parásito debido a su diferenciación biológica, se genera una embriogénesis que dura cuatro días, al quinto día nuevas larvas nacen, demostrando la fertilidad de la hembra.(7)
Estas nuevas larvas arriban a los vasos linfáticos, llegando posteriormente a la circulación general. Es así como se produce una propagación hacia diferentes órganos como el corazón, atravesando pulmones, hígado y concluyendo en una circulación periférica del organismo.(8)
Cuando las larvas de T. spiralis consiguen establecerse en el tejido muscular, se da un aumento de tamaño que puede llegar hasta 1100 micras de longitud y 35 micras de diámetro. Así también, se inicia una diferenciación completa en la cápsula que permitirá aislarla de los ataques inmunológicos que el organismo del hospedador pueda ejercer, esta diferenciación se da entre 15 y 20 días después de la infección. La cápsula tiene una estructura quística, lo que le permite a la larva alojarse en ella por mucho tiempo. Una vez que larva llegue a su estadio adulto, se alojará en el tracto intestinal del huésped.(7,8)
Las características más importantes en el ciclo de vida de la T. spiralis son las tres etapas que presentan únicamente dentro del huésped:
· Gastrointestinal
· Invasión a los tejidos
· Convalecencia
La primera etapa gastrointestinal, suele confundirse con otras patologías digestivas semejantes debido a signos de intoxicación alimenticia. Sin embargo, esta etapa es en donde se producen los parásitos y se alojan en la mucosa intestinal, acompañado de vómito, cólicos, diarrea, entre otros. La primera etapa, puede llegar a extenderse hasta 7 días en el intestino, y 3-4 semanas los parásitos adultos, el tiempo va a variar según sea la respuesta del sistema inmunitario del huésped, y es justamente aquí en el que se acciona los antígenos de superficie, mediado por la respuesta inmune.(9,10)
En la etapa de invasión, las larvas recién nacidas se distribuyen hacia la luz intestinal, como consecuencia se evidencia todos los síntomas característicos de la enfermedad, así como las alteraciones en el tejido muscular esquelético estriado. En el día 10 después de darse la infección, se generan trastornos inflamatorios generalizados, dolores musculares e hipertermia, inducido por el proceso de degranulación de eosinófilos y mastocitos que se adhieren a la membrana celular, para poder liberar su contenido.(7,11)
El crecimiento de las larvas cesa en el día 20, cuando se ha incrementado su tamaño alrededor de unas 270 veces. T. spiralis exhibe una forma representativa de espiral, recubierta por una capsula de protección, aislando al parasito, de cualquier acción que ejerza el sistema inmunológico.(12,13) Por último, se encuentra la fase de convalecencia, donde tanto los signos como los síntomas de la enfermedad, van disminuyendo, limitando niveles de infección, pese a que en algunos pacientes se puede presentar secuelas que llegan a ser permanentes.(11)
Para su diagnóstico es importante desarrollar métodos serológicos. El método recomendado por la Comisión Internacional de Triquinosis es la técnica de digestión artificial, que consiste en la digestión in vitro del tejido muscular con HCl y pepsina, seguida de observación microscópica y cuantificación de las larvas del parásito. Se utilizan métodos directos e indirectos específicos para identificar Trichinella spp., pero para identificar especies o genotipos mediante PCR.(12,13) La PCR en tiempo real es la amplificación selectiva de regiones específicas dentro del ADN objetivo. Esto permite la medición cualitativa y cuantitativa del ADN del parásito.(14)
En Ecuador, la crianza de cerdos en el traspatio de las viviendas representa una actividad económica importante y de consumo interno. Por ello, el 40 % de la producción de cerdos a nivel nacional tienen su crianza en el traspatio. A pesar del gran porcentaje de cerdos criados en condiciones de poca salubridad, Trichinella spp. no es un parásito que se sigue de cerca por las agencias de control en Sanidad Animal e Inocuidad Alimentaria en los camales del país.(15,16)
El objetivo principal de esta investigación es caracterizar los mecanismos de patogenicidad de la Trichinella spiralis y su incidencia en Ecuador mediante una exhaustiva revisión bibliográfica.
MÉTODO
El trabajo de investigación consiste en realizar una revisión bibliográfica de tipo narrativo descriptivo de carácter retrospectivo que permitiera profundizar en las características la Trichinella spiralis y su incidencia en Ecuador, para lo que se recurrió a bases de datos en línea como PubMed, Scielo, ScienceDirect, Elsiever, Google Académico, publicados desde el año 2019 hasta el 2023.
Para realizar la búsqueda de la literatura se emplearon palabras claves como: Trichinella spiralis, triquinosis, parasitosis, estadios parenterales, trichinelosis, parásito, patogenicidad, sanidad animal y Ecuador. Además, se usaron términos MeSH (Medical Subject Headings) como tesauros y también operadores booleanos como AND y OR para ayudar con la estrategia de búsqueda.
Criterios de inclusión
· Artículos científicos originales y tesis que reporten la prevalencia o incidencia de triquinosis o infección por Trichinella spiralis de diferentes provincias, cantones y parroquias del Ecuador con fecha de investigación y publicación desde el año 2017 hasta el año 2022.
· Artículos científicos y tesis publicados en español o inglés.
Criterios de exclusión
· Artículos científicos y tesis que no tengan temas relacionados con respuesta inmunitaria o mecanismo de infección por Trichinella spiralis publicados hace más de 5 años.
· Artículos científicos que no estén publicados en idioma español o inglés.
· Artículos de opinión, artículos de enfoque pedagógico y ensayos investigativos puesto que estos no tienen evidencia científica y no aportaran información útil que nos permita entender los mecanismos de acción de Trichinella spiralis.
Toda la información fue agrupada con el único fin de sintetizar y facilitar su comprensión, tomando en consideración datos del autor, año de referencia, fecha de su estudio y publicación, población estudiada: dependiendo su género, edad, factor de riesgo y los resultados que se han obtenido.
Según los criterios de inclusión y exclusión se seleccionaron un total de 147 artículos científicos por medio de las diferentes bases de datos en línea de los cuales fueron elegidos 32 artículos después de estudiarlos y analizarlos para la investigación, el resto se excluyó por presentar artículos repetidos, incompletos y artículos que no tienen la variable de investigación.
Para el análisis de los resultados se utilizó el método Preferred Reporting Items for Systematic (PRISMA) y se siguió el diagrama de flujo el cual consta de cuatro fases los cuales son identificación de los resultados en bases de datos, el screening y elegibilidad según los criterios fijados, así como los artículos incluidos en esta revisión bibliográfica.
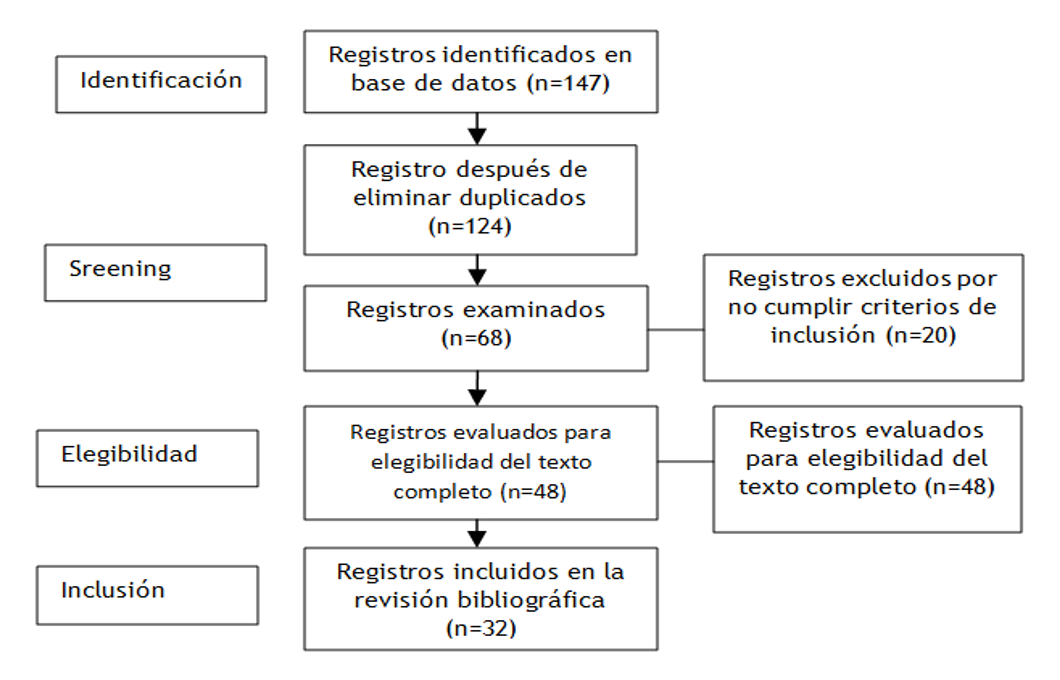
Figura 1. Diagrama de flujo de artículos incluidos en la revisión bibliográfica basado en el método PRISMA
RESULTADOS
A nivel mundial han sido reportados múltiples casos de triquinosis, con excepciones de las zonas que son desérticas, entre ellas algunas regiones de África, puesto que, no se han ejecutado análisis de estudios en estas localizaciones. Sin embargo, se estiman 10 000 casos de triquinosis a nivel mundial por año.(17)
En los últimos 5 años se ha dado un incremento, que comprende una situación epidemiológica grave, tanto en Francia e Italia, quienes encabezan la línea con más casos de contagio, debido a su consumo de carne equina que es característico de Europa.(17) A nivel de Latinoamérica, como en Argentina, Chile y México, la triquinosis, es endémica, cada uno de los casos que se presentan en estos países, se debe a la ingesta de embutidos caseros, carne de cerdo infectada, o que se encuentre mal cocida. El país con más casos reportados es Argentina, dado que existe ausencia de control profesional y un alto índice de faena doméstica ilegal sin control.(17,18)
En estudios previos realizados en Ecuador, se analizaron muestras de suero mediante ELISA y los resultados mostraron una prevalencia del 0 % en 331 cerdos y del 0,35 % en otros 2000 cerdos criados en interiores, mientras que la prevalencia en 646 cerdos en libertad fue del 5,72 %. Sin embargo, la presencia del parásito no pudo ser confirmada por medio de métodos parasitológicos.(18)
En reacción al contacto de Trichinella con el organismo y su respuesta inmunitaria, promueve la inflamación, producto de la introducción del parasito a las células epiteliales del intestino. Se da la liberación de interleucinas, los cuales son mediadores proinflamatorios, favoreciendo la penetración de mastocitos, y una elaboración de IL-3, IL-4 e IL-5. Sin embargo, se produce un aumento de concentración de la histamina y de los leucotrienos, principales agentes responsables en dañar la mucosa intestinal.(19) En todo el proceso de infección, predomina la respuesta humoral de pacientes con T. spiralis, siendo los anticuerpos IgE, IgA, IgM e IgG, detectados en el transcurso del tiempo de infección.(20)
La infección de Trichinella spiralis, tienen un efecto de supresión al sistema inmunitario, haciéndolo totalmente invisible ante ataques invasivos de eliminación. El parásito, conforme avanza su ciclo de vida, cambia su morfología y excreción, lo que le permite migrar con linfa o sangre, invadiendo el músculo esquelético.(21)
Los parásitos adultos, son quienes manifiestan la infección, acompañada de nauseas, diarrea, y vómitos, síntomas que se le adjunta a una gastroenteritis, pese a que, es un diagnóstico erróneo. En la fase enteral, se tiene un periodo de incubación de 12 horas a 2 días después de haber ingerido la carne infectada, este está delimitado por la carga parasitaria presente. En la fase parenteral, tenemos manifestaciones clínicas patognomónicas de la triquinosis.(10,11,22) Las larvas se liberan en el intestino delgado y maduran en adultos en el lumen intestinal. Después de la fecundación, las hembras liberan larvas recién nacidas que penetran en las criptas intestinales y entran en la circulación sanguínea o linfática.(23)
Las larvas migran a varios tejidos, incluyendo músculos esqueléticos, donde forman quistes encapsulados. La respuesta inmune del huésped es crucial en la formación de estos quistes. La respuesta inmune innata y adaptativa contribuye a la encapsulación de las larvas en los tejidos musculares, lo que limita su movimiento y reduce el daño tisular. Esto también lleva a la formación de una respuesta inflamatoria localizada. La fisiopatología de Trichinella spiralis involucra diversas etapas que ocurren desde la ingesta del parásito hasta la manifestación de los síntomas clínicos.(24)
Las personas se infectan al ingerir carne cruda o apenas cocida que contiene larvas encapsuladas de Trichinella spiralis. Estas larvas provienen de tejidos musculares de animales como cerdos, jabalíes, osos y otros mamíferos infectados. Las larvas penetran la mucosa intestinal y se desarrollan hasta la fase L2 en el intestino delgado. Luego, migran a través de la circulación sanguínea y los vasos linfáticos, alcanzando diversos tejidos, especialmente los músculos.(24) En el estómago, los ácidos gástricos disuelven las cápsulas protectoras de las larvas, liberándolas en su forma larval (L1) en el intestino delgado.(25)
Una vez en los tejidos musculares, las larvas pasan por una serie de transformaciones y se encapsulan en quistes llamados "cápsulas de Trichinella". Esto es una respuesta del sistema inmunológico para intentar contener la infección. La migración y encapsulación de las larvas en los tejidos musculares pueden causar una respuesta inflamatoria localizada. Esta inflamación puede provocar dolor muscular, hinchazón y sensibilidad en los músculos afectados.(25)
Los síntomas clínicos de la triquinosis pueden variar según la carga parasitaria y la respuesta inmunológica del huésped. Los síntomas pueden incluir fiebre, dolores musculares intensos, edema facial (hinchazón alrededor de los ojos), debilidad, fatiga, náuseas y vómitos. En casos graves, la triquinosis puede causar complicaciones como daño cardíaco, pulmonar o neurológico. Estas complicaciones pueden surgir debido a la migración de las larvas a través de diferentes tejidos y la respuesta inflamatoria asociada.(24,25)
Cuadro clínico del paciente
Trichinella spiralis causa la triquinosis, enfermedad que no siempre se presenta con sintomatología, y cuando lo hace, sus síntomas son inespecíficos y se les atribuye a otras enfermedades, lo que conlleva a que su diagnóstico sea vuelva complicado. Los síntomas se inician con molestias gastrointestinales, fiebre, mialgia y edemas, que pueden convergir en problemas cardiacos e incluso llevar a la muerte si no se llega a tratar a tiempo. Estas complicaciones dependen de la magnitud que se encuentre infectada la carne ingerida, así también, como la cantidad que consumió, puesto que existe un límite letal de ingesta por larvas de Trichinella spiralis que se aproxima a 5 larvas por gramos del peso corporal. El encapsulamiento de las larvas en los órganos vitales también puede resultar en un descenso del paciente, por sepsis, daño renal, hepático e incluso cerebral.(26)
Dentro de la Trichinella spiralis se encuentran diferentes etapas, donde se caracteriza por síntomas asociados a cada uno de los estadios:
· El primer estadio: normalmente se puede tergiversar con una intoxicación alimentaria, ya que sus síntomas incluyen náuseas, vómitos, fiebre de 38°C y diarrea. Este cuadro, tiene lugar cuando las larvas, empiezan a evolucionar en el intestino.
· El segundo estadio: caracterizado por la complejidad en la que se puede llegar a desarrollar y en la que usualmente fallece el paciente, por la penetración de las larvas hacia las fibras musculares, puede verse implicado el musculo cardiaco. En este estadio, se presenta fiebre, cefalea, sudoración y edemas, con una inflamación de los músculos.
· El tercer estadio: En casos más graves, la etapa de convalecencia se alarga meses. En el tercer estadio, se da comienzo a la fase de enquistamiento, lo que produce fiebre, disnea y dolor muscular intenso. Los síntomas desaparecen después de 1 a 6 semanas de iniciada la etapa, con el encapsulamiento de todas las larvas. Desarrollándose una inmunidad, puesto que todos los valores de laboratorio retornan de manera normal. No obstante, se involucran complicaciones neurológicas, cardiovasculares y, en muchos casos, respiratorias.(27)
Respuesta inmunitaria
Lo característico de la T. spiralis es su capacidad de evadir la respuesta inmune del hospedador, un indicativo de inhibición que no puede ser completado por el huésped. En las diferentes etapas de la T. spiralis, la inmunidad celular, se llega a inhibir, y en etapas especificas se activa, produciendo antígenos específicos de fase en cada etapa, desempeñando un papel de resistencia durante la infección, que permite inducir una respuesta inmune especifica, misma en donde actúan, las células Th1/Th2 que mantienen un equilibrio de la respuesta inmunitaria, si se llega alterar o desequilibrar, el hospedador se contagiará. Como tal, todo el sistema inmunológico se verá afectado, y las células Th1/Th2 se inhibirá, incitando a una nueva célula aparecer, la célula Treg, esta va a minimizar el proceso inflamatorio.(28)
Una vez infectado el huésped, se activa la expresión de IL-2, precursora de Th1, que desencadena IFN-C (interferones) una defensa del huésped, sin embargo, a las 30 horas después de la infección, la expresión disminuye drásticamente, aumentando así los niveles de TGF-B (factor de crecimiento transformador-beta), que es una proteína implicada en el proceso biológico que inmunosuprime a las células Th1/Th2. Como producto de este aumento, no se da la eliminación completa del parásito.(29)
Parte del mecanismo de respuesta del organismo frente a este desequilibrio y la no erradicación del parásito, incita la respuesta inmunitaria con células Th2. El aumento del peristaltismo intestinal, la diarrea, el cuadro clínico del paciente, se opera gracias a la activación de IL-4, de mastocitos, en correlación a un intento de eliminación del parásito; la IL-4, libera histamina y serotonina, responsables del cuadro clínico.(28,29)
Durante la fase intestinal, T. spiralis induce una respuesta inmune de tipo Th1. La respuesta con células Th2 se activa cuando el parásito ingresa al enterocito y adquiere el fenotipo característico, que se da durante la infección muscular. La respuesta de Th2 a los parásitos está controlada por las células T+CD4 y depende del inicio de niveles altos de citocinas de tipo 2 (interleucina-4, IL-5, etc.). La respuesta inmunitaria Th2 acelera la formación de quistes, impidiendo que el sistema inmunitario destruya a la T. spiralis.(30)
Las células T, también juegan un papel importante durante la infección, por medio de productos excretores-secretores del parásito que estimulan la diferenciación de células Treg del huésped, esta disparidad se da gracias a las células dendríticas. Las células T por la interacción de expansión, activación y diferenciación se resulta en un subconjunto con denominación de células Th1, Th2 y células T reguladoras o conocidas en este texto como células Treg. Durante la fase muscular, en donde el parasito, se encuentra dentro de un quiste, la comunicación que se ejerce con el huésped es a través de los productos excretores-secretores del parásito. Las células Treg producen citocinas reguladoras, suprimiendo la respuesta inmunitaria de partículas extrañas o propias, en este caso del parásito. Permite la evasión inmune del patógeno, previniendo efectos mortales para el huésped.(30)
En los tipos de células Treg, radica las células Treg naturales, que expresan CD4+CD25+ FOXP3 +, dependientes de IL-2. Son quienes permiten la inhibición de producir citocinas por las células Th1, Th2 y CTL mediante la liberación de IL-10 y TGF-beta.(28)
La estrategia sofisticada e inteligente de inflexión del sistema inmune por T. spiralis para evadir el ataque inmunológico, se centra en la paramiosina, que modula la diferenciación de células Treg para comprimir la respuesta inmune adquirida del huésped como un T. spiralis táctica de supervivencia para existir en el huésped, así también libera la especificidad de sus proteínas y otras moléculas que obstruyen la respuesta inmune del huésped, permitiendo ocultarse de la detección y ataque del sistema inmunitario.(29)
La forma de comunicación entre el parásito T. spiralis y el hospedador, es producida por “puentes” denominados exosomas, que sirven como medio de manipulación, en el cual, el parásito puede determinar cuándo y cómo reaccionar frente al anfitrión. Estos exosomas influyen sobre la funcionalidad de barreras protectoras y sobre las células epiteliales intestinales, en sí, los exosomas, median la comunicación con los miARN. El miR-153, es un miARN mecanosensible, que actúa como un factor proapoptótico en las células IPEC (células intestinales) aumentando la proliferación de Bax y Bad agrupados a la vía apoptótica. Por la manipulación de esta vía, es que el parasito evade la detección y se sigue proliferando en el huésped sin ser eliminado por el sistema inmunitario.(31)
DISCUSIÓN
La triquinosis a pesar de ser una enfermedad que tiene una incidencia que se estima en unos 10 000 casos por año, su diagnóstico puede llegar a ser complicado por la ausencia de herramientas claras y sintomatología inespecífica. Sin embargo, la identificación de sus estadios ha ayudado en gran medida a la identificación de casos que varían por su gravedad. Específicamente, Trichinela spirallis, es considerado un parásito de amplia importancia por las características zoonóticas que este posee y la gravedad de los casos en seres humanos si no existe un diagnóstico oportuno, el cual incluso puede llevar hasta la muerte del hospedero.(21,23)
No existe un distintivo el cual se asevere que la persona se encuentre infectada, debido a que trichinella spiralis, tiene signos y síntomas que se puede relacionar con enfermedades distintas.
Así mismo, el mecanismo de evasión a la respuesta inmune es inducida por Th1, Th2, a lo que se encuentra en conflictos con la parte patológica e inmunológica, ya que, Th1 y Th2 forma parte de un mecanismo de destrucción y reparación, respectivamente, con activación de macrófagos IL-6. Las técnicas basadas en la amplificación del ADN por PCR (reacción en cadena de la polimerasa), como el método multiplex PCR y RFLP (Restriction Fragment Length Polymorphism), permiten la detección y diferenciación de ejemplares parasitados por Trichinella spiralis a nivel de especie.
La infección inicial ocurre principalmente a través de la ingestión de carne cruda o insuficientemente cocida que contiene larvas encapsuladas de Trichinella. Las larvas liberadas en el estómago se convierten en formas maduras en el intestino delgado. Las larvas adultas producen descendencia que penetra en la mucosa intestinal y migra a través del torrente sanguíneo y los tejidos, causando daño físico a las células y tejidos circundantes.(19)
Una vez que las larvas migratorias penetran en los tejidos, tiende a encapsulación en tejido muscular, se en quistes intracelulares. Estos quistes pueden causar inflamación y daño tisular localizado, lo que puede resultar en dolor muscular, fiebre y otros síntomas.
En la Interacción con el sistema inmunitario del hospedador, durante la fase de migración y encapsulación, Trichinella modula la respuesta inmunitaria del hospedador para evadir su detección y eliminación. Suprime las respuestas inmunitarias innatas y adaptativas, lo que permite su supervivencia en el tejido del hospedador. Además, secreta moléculas que interfieren con la activación de células inmunitarias, como los linfocitos T y las células dendríticas.(32)
La trichinelosis induce una respuesta inmunitaria innata que incluye la liberación de citocinas proinflamatorias, como interleucinas y factor de necrosis tumoral alfa (TNF-α). Estas citocinas contribuyen a la movilización de células inmunitarias y al reclutamiento de neutrófilos y macrófagos al sitio de infección.(23)
Tras la migración y encapsulación de las larvas, se desarrolla una respuesta inmunitaria adaptativa, principalmente mediada por linfocitos T. Se generan tanto respuestas de tipo Th1 como Th2. La respuesta Th1 implica la liberación de citocinas como interferón gamma (IFN-γ), que activan a los macrófagos para atacar a las larvas. Por otro lado, la respuesta Th2 se caracteriza por la liberación de citocinas como interleucina-4 (IL-4) e interleucina-5 (IL-5), que pueden estar asociadas con la formación de quistes.(32)
La falta de mecanismos de detección de Trichinella en la carne porcina y de seguimiento de las prácticas seguras de manipulación y cocción de la carne constituyen un problema de seguridad alimentaria en Ecuador. En este sentido, la detección oportuna de Trichinella representa un desafío para garantizar la inocuidad de los productos cárnicos, lo que tiene implicaciones para la producción y consumo de carne en el país.
La atención y vigilancia continuada sobre la presencia de Trichinella en poblaciones animales y humanas, así como la notificación y manejo de los casos de triquinosis, son aspectos críticos para abordar el problema, implementar estrategias de control y educar a la población sobre las prácticas seguras de preparación de alimentos.
CONCLUSIONES
La triquinosis es una infección que se da por el consumo de carne cruda, proveniente del cerdo y su agente causal es Trichinella spiralis. Trichinella se caracteriza principalmente por ser un parásito que se aloja a nivel muscular, causando un hospedaje que puede durar hasta años. Esta capacidad es brindada por el encapsulamiento del parásito en su fase muscular, gracias a estas cápsulas es que el parásito puede evadir la respuesta inmunitaria y se vuelve difícil de eliminar.
El parásito mantiene 3 estadios que engloba diferentes signos característicos de la enfermedad, sin embargo, en muchos de los casos, no se presenta sintomatología, y el parásito se mantiene en un estado de reposo. Las nuevas larvas, viajan por la sangre o la linfa, llegando a órganos y afectándolos, es así como el parásito alcanza al musculo, en donde se aloja y continúa su ciclo de vida.
La respuesta inmunitaria, detecta anomalías, e inicia mecanismos de defensa, activando las Th1 y Th2, quienes serán responsables, de la formación de la cápsula que permitirá evadir y proteger del sistema inmunitario a Trichinella spiralis, una forma inteligente para no ser detectado. En este proceso participa también las células Treg, de gran importancia para disminuir el proceso inflamatorio.
El arqueo que llega a tener este parásito, por su ciclo de vida amplio y completo, que logra disuadir su ataque, cada una de las células de nuestro cuerpo busca radicar cualquier agente patógeno externo a nosotros, sin embargo, Trichinella, muestra que es posible evitar el sistema inmunitario, formando parte de tejido sano, y convirtiendo las células atacantes a favor de este. Manipula el proceso celular y lo convierte en una fuente de nutrición para sobrevivir.
Trichinella es un parásito que necesita de atención pública y estudios complementarios en relación con el traspatio de cerdos en Ecuador. Al ser un parásito con habilidades de anti-detección, Trichinella se vuelve una fuente de investigación para poder controlar enfermedades que afectan a la sociedad y aún no se halla una cura. El ciclo de vida del parásito es la respuesta por encontrar, para que en un futuro se controlen y no se diseminen enfermedades terminales producto de la reversión del proceso de encapsulamiento y evasión celular.
La incidencia específica en humanos de Trichinella spiralis en Ecuador no es ampliamente documentada en la literatura científica ni en fuentes de salud pública. No obstante, a pesar de que la trichinosis es una enfermedad parasitaria no muy frecuente en es necesario que los profesionales de la salud estén atentos a esta problemática y trabajen de manera conjunta para implementar estrategias de control y prevención efectivas.
REFERENCIAS BIBLIOGRÁFICAS
1. Chelsea M,Petri W. Triquinosis.Manual MSD. (Citado: sept 2022); Disponible en : https://www.msdmanuals.com/es/professional/enfermedades-infecciosas/nematodos-gusanos-redondos/triquinosis
2. Despommier DD. How Does Trichinella spiralis Make Itself at Home? Parasitol Today. 2018 Aug;14(8):318–23. Disponible en: https://www.google.com/search?client=opera&q=2.+Despommier+DD.+How+Does+Trichinella+spiralis+Make+Itself+at+Home%3F+Parasitol+Today.+2018+Aug%3B14(8)%3A318–23.&sourceid=opera&ie=UTF-8&oe=UTF-8
3. Ruvalcaba F, Quezada M, Benavides DE, Chávez MI, 2021;Enfermedades transmitidas por alimentos causadas por parásitos. RevistasUazEduMx. 2020;14(2):151–5. Disponible en: https://revistas.uaz.edu.mx/index.php/investigacioncientifica/article/view/989
4. Carrasco Z, Renato I, Lozano C, Zúñiga Carrasco Av Tecnológico Mz R, del Carmen P, de Solidaridad M, et al. Enfermedades transmitidas por los alimentos: una mirada puntual para el personal de salud. Foodborne diseases: a timely view for health personnel. Enfermedades Infecc y Microbiol. 2017;37(3):95–104. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumen.cgi?IDARTICULO=86155
5. Novoa KE, Santillán JL. Detección de Trichinella spp., utilizando tres técnicas diagnósticas en cerdos de traspatio faenados en la Empresa Pública Metropolitana de Rastro Quito. 2021; Disponible en: https://www.dspace.uce.edu.ec/entities/publication/c2c2f62c-3b8a-465b-847f-b87f17cca565
6. Diaz JH, Warren RJ, Oster MJ. The Disease Ecology, Epidemiology, Clinical Manifestations, and Management of Trichinellosis Linked to Consumption of Wild Animal Meat. Wilderness Environ Med. 2020;31(2):235–44. Disponible en: https://www.researchgate.net/publication/339844452_The_Disease_Ecology_Epidemiology_Clinical_Manifestations_and_Management_of_Trichinellosis_Linked_to_Consumption_of_Wild_Animal_Meat
7. Ministerio de salud Argentina. Guía para la prevención y el control de la Triquinosis/ Trichinellosis. 2021; Disponible en: https://www.argentina.gob.ar/salud/boletin-epidemiologico-nacional
8. Norman F, Antonio J, López R. Boletín de Enfermedades Emergentes. 2015.
9. Liu S, Pan J, Meng X, Zhu J, Zhou J, Zhu X. Trichinella spiralis infection decreases the diversity of the intestinal flora in the infected mouse. J Microbiol Immunol Infect. 2021;54(3):490–500. Disponible en: https://www.sciencedirect.com/science/article/pii/S1684118219301653
10. Steffan P. Triquinosis, una sociedad en jaque. Anales de la Academia de Agronomía y veterinaria. 1998;13–30. Disponible en: http://sedici.unlp.edu.ar/handle/10915/30613
11. Moreno G, Maldonado T, Chávez I, Reveles H, Rosa G; Quiroz Z, et al. El estudio de Trichinella spiralis en modelos experimentales. REDVET. Revista Electrónica de Veterinaria, 2012;13(7):1-12.Disponible en: https://www.redalyc.org/pdf/636/63624404019.pdf
12. Farina A. Trichinellosis: un problema permanente en Argentina . Parte 1 Trichinellosis: a permanent problem in Argentina Part 1. . Rev. med. vet. 2021, 102(3): 01-05. Disponible en: https://www.someve.com.ar/images/revista/2021/Vol102(3)/Pag-01-05-Farina.pdf
13. Riva E, Steffan P, Fiel C. Trichinellosis: Aspectos múltiples de una zoonosis global. FAO Mejor del Control la Trichinellosis. 2007;9(Lm):94–109. Disponible en: http://www.ciap.org.ar/Sitio/Archivos/Trichinellosis%20Aspectos%20multiples%20de%20una%20zoonosis%20global.pdf
14. Ortega MG. La caracterización de los antígenos de superficie del nematodo parásito Trichinella spiralis: estudio de su participación en los mecanismos de protección y su utilidad en el diagnóstico de la triquinosis. Gac Med Mex. 1995;131(1):2–12.Disponible en: https://pesquisa.bvsalud.org/portal/resource/pt/lil-174015
15. Fossaroli MG. Revisión bibliográfica de los diferentes métodos de diagnóstico de laboratorio para Trichinellosis porcina . 2019; Facultad de Ciencias Veterinarias. (Trabajo Fin de Grado Inédito). Disponble en: http://sedici.unlp.edu.ar/handle/10915/80620
16. Pozio E. The impact of globalization and climate change on Trichinella spp. epidemiology. Food Waterborne Parasitol. 2022 Jun;27. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9052037/
17. Rodríguez B, Hernández B, Hernández K, Lema A, Llantuy M. Trichinella spiralis, un parásito subestimado en Ecuador Bradley. Revista Ecuatoriana de Ciencia Animal, 2020; 4(3) p. 78-86, Disponble en: http://www.revistaecuatorianadecienciaanimal.com/index.php/RECA/article/view/32
18. Petrovic J. Important biological characteristics of Trichinella genotypes. Vet Glas. 2019;73(2):100–7. Disponible en: https://scindeks-clanci.ceon.rs/data/pdf/0350-2457/2019/0350-24571902100P.pdf
19. Rodríguez M. Sevilla UDE. Triquinelosis Y Su Situación Actual En Europa. 2021; Universidad de Sevilla. Departamento de Microbiología y Parasitología. (Trabajo Fin de Grado Inédito). Disponible en: https://idus.us.es/handle/11441/133196
20. Chávez MA, Dorny P, Moeller L, Benítez W, Barrionuevo M, Rodríguez R, et al. Survey on porcine trichinellosis in Ecuador. Vet Parasitol. 2005;132(1-2 SPEC. ISS.):151–4.Disponible en : https://pubmed.ncbi.nlm.nih.gov/15978724/
21. Zumaquero JL, Pérez M, Villa A, Sarracent J. La inmunización con productos de excreción-secreción de Trichinella spiralis unido al bloqueo de CTLA-4 produce un elevado grado de protección ante un reto con el parásito. Vaccimonitor. 2017; 26(1). Disponible en : http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-028X2017000100004
22. Moreno MA, Maldonado CH, García EA, Reveles RG, Muñoz JJ. Fase intestinal de trichinella spiralis en modelo murino. Acta Biol Colomb. 2009;14(1):203–10. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-548X2009000100015
23. Rawla P, Sharma S. Trichinella spiralis Infection. Textb Med Parasitol. 2023 May 22;161–161. Disponible en: https://pubmed.ncbi.nlm.nih.gov/30860746/
24. Zarlenga D, Thompson P, Pozio E. Trichinella species and genotypes. Res Vet Sci. 2020 Dec 1;133:289–96.Disponible en : https://pubmed.ncbi.nlm.nih.gov/33199264/
25. Hao C, Wang W, Zhan B, Wang Z, Huang J, Sun X, et al. Trichinella spiralis Paramyosin Induces Colonic Regulatory T Cells to Mitigate Inflammatory Bowel Disease. Front Cell Dev Biol. 2021;9(July):1–18.Disponieble en: https://pubmed.ncbi.nlm.nih.gov/34336843/
26. Ponce de León P, Lamagni E, Bottai H. Trichinella spiralis y Trichinella patagoniensis: cinética de desialización eritrocitaria. Acta bioquímica clínica latinoamericana.2020;54(2). Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-29572020000200009
27. Wang N, Bai X, Tang B, Yang Y, Wang X, Zhu H, et al. Primary characterization of the immune response in pigs infected with Trichinella spiralis. Vet Res. 2020;51(1):1–14.Disponible en: https://veterinaryresearch.biomedcentral.com/articles/10.1186/s13567-020-0741-0
28. Gentilini MV, Venturiello SM. Trichinella spiralis: relación de la infección con el sistema inmunitario de mucosas. Biomédica 2011;31(sup.3):3-315. Disponible en: https://ri.conicet.gov.ar/bitstream/handle/11336/13941/CONICET_Digital_Nro.17201_A.pdf?sequence=2&isAllowed=y
29. Xi-meng S, Guo K, Hao CY, Zhan B, Huang J jing, Zhu X. Trichinella espiralis.Los productos excretores-secretores estimulan la diferenciación de células T reguladoras del huésped mediante la activación de células dendríticas. 2019;1–19. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6912532/
30. Jin QW, Zhang NZ, Li WH, Qin HT, Liu YJ, Ohiolei JA, et al. Trichinella spiralis Thioredoxin Peroxidase 2 Regulates Protective Th2 Immune Response in Mice by Directly Inducing Alternatively Activated Macrophages. Front Immunol. 2020;11(September):1–13.Disponible en: https://pubmed.ncbi.nlm.nih.gov/33072069/
31. Wang R, Lin L, Han Y, Li Z, Zhen J, Zhang Y, et al. Exosome-delivered miR-153 from Trichinella spiralis promotes apoptosis of intestinal epithelial cells by downregulating Bcl2. Vet Res. 2023;54(1):1–17.Dispnible en https://pubmed.ncbi.nlm.nih.gov/37381058/
32. Contreras M del C, Sandoval L, Salinas P, Saavedra T, Schenone H. Inmunodiagnóstico de la triquinosis humana. Boletín Chil Parasitol. 2001 Jul;56(3–4):47–53.Disponible en https://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0365-94022001000200003
FINANCIACIÓN
Ninguna.
CONFLICTO DE INTERESES
Ninguno.
CONTRIBUCIÓN DE AUTORÍA
Conceptualización: Melany Michelle Abril Moya, Graciela Alexandra Carrera Aldaz, Francisco Xavier Poveda Paredes.
Análisis formal: Melany Michelle Abril Moya, Graciela Alexandra Carrera Aldaz, Francisco Xavier Poveda Paredes.
Investigación: Melany Michelle Abril Moya, Graciela Alexandra Carrera Aldaz, Francisco Xavier Poveda Paredes.
Redacción – borrador original: Melany Michelle Abril Moya, Graciela Alexandra Carrera Aldaz, Francisco Xavier Poveda Paredes.
Redacción – revisión y edición: Melany Michelle Abril Moya, Graciela Alexandra Carrera Aldaz, Francisco Xavier Poveda Paredes.